환경기능사 자격증 필기시험 대비 요약
이론 산소량, 이론 공기량, 공기비
건조 공기의 성분 조성은?
(평균 분자량 28.97kg/kmol)
| 구분 | 산소 | 질소 | other |
| 분자식 | O2 | N2 | - |
| 질량분률(%) | 23.20(23.2) | 75.47 | 1.33 |
| 체적분률(%) | 20.99(21) | 78.03 | 0.98 |
건조 공기의 대략적인 성분 조성은 질소와 산소만으로 이루어진 것으로 가정하고, 산소를 제외한 성분은 모두 질소로 취급한다. 따라서 공기는
체적분율로 산소 21.0%, 질소 79.0%,
질량분률로 산소 23.2%, 질소 76.8%로 취급하고
공기의 상당 분자량은 28.97kg/kmol로 계산한다.
산소 O2 = 32g
질소 N2 = 28.02g
32g x 23.20%(중량비) = 7.42
28.02g x 75.47%(중량비) = 21.15
산소, 질소 합계 28.57 + Other = 28.97kg/kmol
연료 구성 원소의 완전연소에 필요한 공기량
| 원소명 | 원자량 | 고발열량 (MJ/kg) |
저발열량 (MJ/kg) |
필요산소량 | 필요공기량 | ||
| kg/kg | m3N/kg | kg/kg | m3N/kg | ||||
| 탄소 C | 12.01 | 32.76 | 32.76 | 2.66 | 1.87 | 11.48 | 8.89 |
| 수소 H | 1.01 | 141.8 | 120.0 | 7.94 | 5.56 | 34.21 | 26.48 |
| 유황 S | 32.06 | 9.26 | 9.26 | 1.00 | 0.70 | 4.30 | 3.33 |
| 산소 O | 16.00 | 0 | 0 | -1.00 | -0.70 | -4.31 | -3.34 |
| 질소 N | 14.01 | 0 | 0 | 0 | 0 | 0 | 0 |
이론산소량(Oo) - 고체, 액체연료
★ 연료의 연소에 대한 필요한 산소의 중량

분자량으로 수치를 계산할 수 있다.
C + O2 = CO2, 12 + 32와 반응, 32/12 = 2.667
H2 + O = H2O, 2 + 16과 반응, 16/2 = 8
S+ O2 = SO2, 32 + 32 반응, 32/32 = 1
O = -1
** 연료 중에 포함된 산소량은 그대로 빼준다.
★ 연료의 연소에 대한 필요한 산소의 부피

중량 대비 70%로 부피비를 적용한다.(이유는?)
2.667 x 70% = 1.867
8 x 70% = 5.6
1 x 70% = 0.7
-1 x 70% = -0.7
** 외울 것도 없이 분자량으로 계산되는 중량 대비 수치만 기억하면 부피 대비 비율을 쉽게 알 수 있다. 교재에 이유는 설명이 없다.
■문제, 석탄의 중량비가 C/H/O/S = 86%/4%/8%/2% 일 때, 석탄을 연소할 경우 필요한 이론 산소량(Sm2/kg)은?
산소량 단위가 부피로 제시됨
1.867C +5.6H +0.7S - 0.7O
= 1.867X 0.86 + 5.6 X 0.04 + 0.7X0.02 - 0.7X 0.08
= 1.605 + 0.224 + 0.014 - 0.056= 1.787 Sm2/kg
석탄을 연소할 경우 필요한 이론 산소량(kg/kg)은?
산소량 단위가 중량으로 계산하면
2.667C +8H +1S - 1O
= 2.667X 0.86 + 8 X 0.04 + 1 X0.02 - 1 X 0.08
= 2.293 + 0.32 + 0.02 - 0.08
= 2.553 kg/kg
산소요구량(중량)에 70%를 하면 산소 요구량(부피)이 나온다.
= 2.553 X 70% = 1.787 Sm2/kg
기체 연료의 이론적 산소요구량
기체의 연소는 CH + O2의 반응이다.

C = C +O2 = CO2로 반응하고
= C 1개와 O2 1 개가 1 : 1 반응 m = m으로 그대로 가져온다.
= mCO2
H = H2 + O = H2O로 반응한다.
= H 2개와 O2가 반개 2 : 1/2로 반응 , 1 : 1/4로 반응한다.
= 1/4H + O2
= n/2 H2O
** 먼저 반응 각각의 량을 알고
산소 중량 = 32 (산소 1개와의 반응식이니까)
연료의 중량은 = 12m + 1n (C, H 량)
반응 산소량은 = (m + n/4) O2
(m + n/4)가 중요한 포인트이다.
★연료 무게당 산소 요구량(중량)
(m + n/4) X ( 산소 중량 / 연료 중량(CH))
= (m + n/4) X 32 / (12m + 1n)
★연료 무게당 산소 요구량(부피는 70%)
(m + n/4) X ( 산소 중량의 70% / 연료 중량(CH))
= (m + n/4) X 22.4 / (12m + 1n)
★연료 부피당 산소 요구량(부피는 70%)
(m + n/4) X ( 산소 부피량 / 연료 부피량)
= (m + m/4) X (22.4 / 22.4)
= (m + n/4)
** 부피는 같은 량으로 반응한다.
이론 공기량(Ao) - 고체, 액체
산소 반응식에서 공기 중 산소량은 (중량은 23.2%, 부피는 21%)
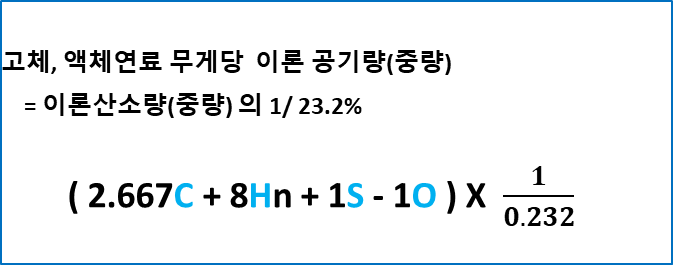
★고체, 액체 연료 무게당 공기 요구량(중량, 23.2%)
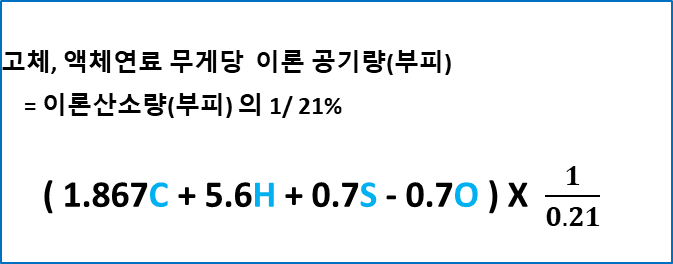
★고체, 액체 연료 무게당 공기 요구량(부피, 21%)
★기체 연료 중량당 공기 소요량(부피, 21%)

★기체 연료 부피당 공기소요량(부피, 21%)
기체의 부피는 1:1로 반응한다. (중량과는 차이가 있다 1/1로 반응)

유효 수소(available hydrogen), 자유수소(free hydrogen)
연료가 산소와 반응하여 연소할 때의 발열량에 기여하는 순수 수소량.
연료 중에 포함되어 있는 수소 원자 중 물(H2O) 형태로 존재하는 수소는 발열량에 기여하지 않는다. 연료의 분석 결과로부터 수소와 산소와의 양을 알고 산소량의 1/8이 H2O를 형성하고 있는 수소라고 생각하여 이를 발열량에 기여한 수소량( H - O/8(7.94))으로 하고 유효 수소라고 한다.
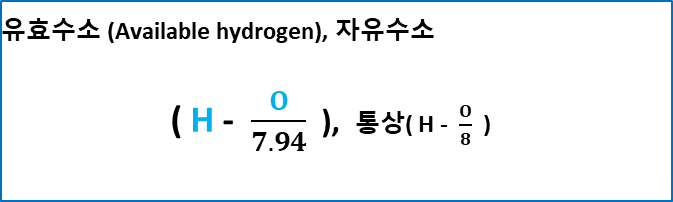
이론공연비(理論空燃比)
어떤 연료 1kg을 완전 연소시키는 필요한 이론 공기량(Lth)을 그 연료의 이론공연비라 한다
연소 처리법 별 적정온도는? ★
직접연소법 650~800℃
촉매산화법 300~400℃
촉매3-4 직접연소는 두배 65-8
** 가끔 이문제도 나온다 머리아프다
연소 시 공기비가 클 때 나타나는 현상은?
** 자주 출제되는 문제이다.
공기비가 높다는 것은 연소반응의 산소량이 적다는 말이다.

열손실 증가 (산소 외 다른 공기를 데워야 하기에)
연소실내의 온도 감소(화력이 약하다)
배기가스 중 SOx, NOx 발생량 증가(불완전 연소의 확률이 높다)
오염물질 희석효과 증가(희석, 공기가 많아서?)
■문제, CH4 94%, CO2 4%, O2 2%인 기체 1Sm3/kg에 대하여 9.5m^3을 사용하여 연소, 공기비는?
기본 반응식 = 연료 + 산소 = 이산화탄소 + 물
반응식 = CH4 + 2O2 = CO2 + 2H2O
실제공기량(A) = 9.5m3
이론산소량(Oo)
= 실제 연료 중 94%가 연료이다.
= (m + n/4) X 94% = 1.88 Sm3
= 첨가된 산소량 2% 차감
= 1.88 - 0.02 = 1.86
Oo = 1.86
이론공기량(Ao)
Ao = Oo / 0.21 = 1.86 /0.21 = 8.857
공기비
m = A / Ao
m= 9.5/8.857 = 1.0725
** 조금만 응용하니 머리가 터지겠음.
발열량
단위질량의 연료가 완전연소했을 때 방출하는 열량
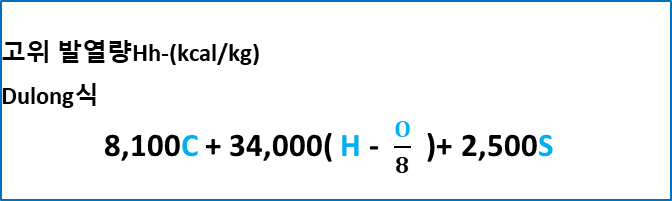
★ 고위(Hh) 발열량(듀롱식)
** 원소분석에 의한 측량법이다.( 시험에 나올 수도 있다)
- Higher heating value
총발열량이라고 한다. 연료 중의 수분, 연소에 의해 생성된 수분의 응축열을 포함한 열량
★ 저위(Hl) 발열량
- Lower heating value
고위발열량에서 수분 및 연소에 의해 생성된 수분의 응축열을 제외한 열량,
통상적으로 소각로의 설계기준이 되는 진발열량. 시험문제는 저위발열량 구하기가 더 많이 나온다.
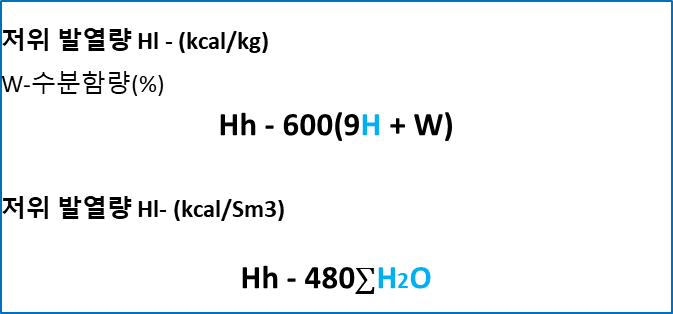
고위, 저위발열량 구하기 문제풀이는 여기로
폐기물의 발열량을 측정하는 실험장치는?
Bomb Calorimeter
** 밤 칼로리미터, 칼로리를 기억하면 된다. 지문에 열량(칼로리)측정이라고 되어 있다.
** 시험에 가끔 나온다. 사실 책에서 안나오는 것은 없다. 자주나오냐, 가끔 나오냐의 차이일 뿐
저위발열량 측정방법은?
단열열량계로 측정
추정식에 의한 측정법
원소분석에 의한 측량법
연소 후 최대 이산화탄소 량 측정

CO2max 구하기 문제풀이는 여기로
■■
'기능사자격증으로 > 환경기능사 필기 대비' 카테고리의 다른 글
| 환경기능사 필기시험 대비 요약 - 물과 수질화학 (0) | 2022.05.09 |
|---|---|
| 환경기능사 필기시험 대비 요약 - 유해가스 처리 (0) | 2022.05.09 |
| 환경기능사 필기시험 대비 요약-대기오염, 집진장치 (0) | 2022.05.08 |
| 환경기능사 필기대비 요점 - 연료와 연소 (0) | 2022.05.03 |
| 환경기능사 필기대비 요점 - 대기 오염현상과 광화학오염 (0) | 2022.05.02 |
| 환경기능사 필기시험대비 요약, 대기 오염물질 (0) | 2022.05.02 |
| 환경기능사 필기대비 요약 - 대기환경 (0) | 2022.04.30 |



