수소(Hydrogen) - 생명의 원천
태초에 하느님이 하나를 만들었으니 수소(H) 니라. 수소는 산소와 함께 생명의 원천인 물을 만들고, 구름 그리고 강을 만들어내기도 하며 탄소, 질소, 산소와 결합하여 모든 유기체의 혈액과 유기물질을 연결하기도 한다. 결정적으로 수소는 별(항성, 태양)을 만든다.
수소원자가 어떻게 쓰이고 무엇을 하는지 알아본다.
1. 수소가 하는 일
수소는 태양의 연료이다.
수소가 핵융합하여 헬륨으로 바뀌는 과정에서 열과 빛을 내는 것이 태양, 별, 항성이다. 태양은 매초 6억 톤의 수소를 태워 5억 9천6백만 톤의 헬륨을 만든다. 나머지 400만 톤은 우리 태양계에 에너지로 쏟아낸다. 열과 빛에너지로 그 에너지가 우리 지구의 모든 생명이 살아가는 것이다. 수소가 없으면 지구의 생명은 없다. 원자번호 1번 수소는 절대적인 존재인 것이다.
수소에는 자연에서 발견되는 동위원소
1H (중성자 0), 2H(중성자 1), 3H(중성자 2) 세 개가 있다.
1H(H)는 자연에서 발견되는 수소 중 99.98%를 차지하는 가장 흔한 동위원소로 원자핵이 양성자 단 하나로 이루어져 있어 경수소라고도 한다.
2H(D, Deuterium)는 중수소라고 불리며, 원자핵이 양성자 하나와 중성자 하나로 이루어져 있다. 중수소가 많이 포함된 물을 중수라고 부르며 중성자 감속재나 원자로 용매로 사용된다. 방사성을 띠지 않으며 핵융합의 잠재적 연료이기도 하다. 중수소로 만들어지는 물은 "H2O, 경수"가 아니라 "D2O, 중수"로 표기하기도 한다.
3H(T, Tritium)는 삼중수소라고 불리며, 원자핵이 양성자 하나와 중성자 두 개로 이루어져 있다. 삼중수소는 반감기가 12년 정도로 방사성을 띠고 있다. 적은 양의 삼중수소가 자연에 존재한다. 삼중수소는 핵무기 실험이나 핵발전소에서 방출되기도 하는데 방사능 물질이라 위험하다.
시계의 표식(인과 결합하여 야광시계를 만든다)에 미량의 삼중수소가 사용된다. 베타 붕괴로 인해 일정한 전자 흐름을 방출하는데 이 입자는 낮고 안정적인 빛을 방출한다. (미해군 SEAL , Luminox 시계) 하지만 삼중수소의 반감기가 12년이라 시간이 지나면 야광시계의 빛이 감소한다.

수소와 물
일상에서 수소를 단독으로 접하기는 쉽지 않고 대부분이 화합물로 존재한다. 그 대표적인 것이 물이다. 물(H2O)은 수소와 산소를 혼합한 뒤 방전을 일으켜서 만들어 낼 수 있다. 열량이 없고 유기 영양분을 제공하지는 않지만 생명을 유지하는데 없어서는 안 되는 필수적 요소다.

물의 끓는점은 기압에 따라 다르다.
(다른 액체도 유사하다) 보통 해수면 높이에서는 100 °C 에 끓어 기화되지만 높은 산 위에서 물은 68 °C 에 끓고 이와 반대로 열수구 주위의 깊은 바닷속 열수구 주위의 물은 100 °C가 되어도 액체 상태를 유지한다.
물의 끓는점은 다른 액체들보다 상당히 높은 수준이고 상당한 에너지를 필요로 하는 것이다. 어떤 액체는 상온에 그냥 두어도 끓는다. 물이 끓는다는 것은 H2O(물)가 산소, 수소로 분리되는 건 아니다.
물은 응고될 때는 부피가 약 10% 증가한다. 부피증가는 밀도의 감소이다. 이런 이유로 얼음(또는 빙하)이 물에 뜨게 되는 이유이고 겨울철에 수도관이 얼어서 터지는 이유이다. 수증기로 기화하면 액체상태의 부피 보다 1,200배 이상 부피가 증가한다.
물과 음펨바효과 - 뜨거운 물은 축적된 에너지 양이 많아 냉각시 더 빠른 속도로 에너지를 방출하게 되는데, 뜨거운 물이 찬물보다 더 빨리 어는 현상을 말한다.
수소에너지로 가는 자동차
수소를 공기 중에 태우면
급격히 불에 타는 가연성 연료이다. 수소가 연소할 때에는 폭발음과 함께 무색의 불꽃을 내며 타는데, 이때 수소와 산소가 반응하여 물 분자가 형성된다. 에너지효율에 있어서 휘발유의 4배 정도로 높다. 매연가스가 아니라 배출물로 물이 나온다. 청정에너지로 수소에너지가 대두되는 이유이고 우주선의 연료로도 사용한다.
2 H2 + O2 → 2 H2O
그러면 수소는 어떻게 구할까?
물을 끓이면 기체가 된다. 수소, 산소로 분리되어 공기 중으로 날아가는 수소를 붙잡는 생각은 하지 말자. 물을 끓이면 수소, 산소로 분리되어 날아가는 게 아니라 그냥 물분자의 기체 상태일 뿐이다. 수소결합과 공유결합으로 되어 있는 불분자에서 수소를 떼어내기가 쉽지 않다. 고작 물이고 간단한 화학식이지만 엄청난 에너지가 필요하다. 인위적으로 분리하기 위해서는 전기분해를 해야 한다.
전기분해로 수소, 산소 분리
2 H2O → 2 H2 + O2
H2와 O2의 계수비에 따라 발생하는 수소:산소 기체의 부피비 = 2:1이다.
2. 수소원자 H(Hydrogen)
원자번호 :1
양성자 : 1
원자량 : 1.008
중성자수에 따라
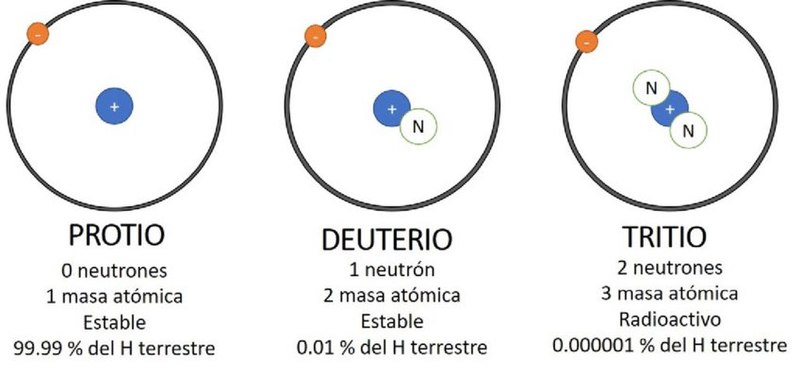
수소(중성자 0, 99.985%), 중수소(중성자 1), 삼중수소(중성자 2)
가장 일반적인 수소(경수소)는 아래 그림처럼 중성자가 없다. 그래서 원자량이 1이다. 별도로 중성자를 1개 또는 2개를 가진 수소도 소량으로 있다.

그림출처 : File:EMclrZrXkAAbthj.jpg - Wikimedia
수소는 가장 흔하면서도 가장 가벼운 원소이다. 물리학자와 화학자들이 가장 사랑하는 원소로 그 이유는 하나의 양성자와 하나의 전자를 가지고 있어(중성자가 없다) 양자법칙에 정확하게 맞기 때문이다.
그래서 수소가 NO.1이다.
** Tip
원자번호()는 원자의 양성자의 수
원자량은 탄소 원자량 12에 비례한 수치이다.
수소- 원자번호 1, 양성자 수 1, 원자량 1
헬륨 - 원자번호 2, 양성자 수 2, 원자량 4
탄소 - 원자번호 6, 양성자 수 6, 원자량 12
산소 - 원자번호 8, 양성자 수 8 , 원자량 16
동위원소 양성자수는 같으나 중성자수가 다른 원소
동위 원소의 개념이 분명해진 뒤, 같은 원소의 원자에도 무게가 다른 것이 있음이 밝혀지고 그 평균을 나타내는 것으로 되었다. 1962년 이후 질량수 12인 탄소 원자의 질량을 기준으로 삼게 되었다.
다음 원소는 목소리를 변조하는 원자번호 2번 헬륨이다.
■■
'원소 스토리' 카테고리의 다른 글
| 원자번호 5, 붕소(Boron) - 다이아몬드보다 강하게 (0) | 2023.03.07 |
|---|---|
| 원자번호 4, 제임스 웹 반사거울을 만드는 베릴륨(Beryllium) (1) | 2023.03.07 |
| 원자번호 3, 배터리의 재료 리튬(Lithium) (0) | 2023.03.02 |
| 원자번호 2, 헬륨풍선을 만드는 헬륨(Helium) (0) | 2023.03.02 |
| 특별한 금속, 수은(水銀)의 중독과 참치 (0) | 2022.05.11 |
| 제설제 염화칼슘(CaCl2)의 용도와 위험성 (0) | 2021.11.25 |
| 터치 액정에 사용되는 금속, 인듐 (0) | 2021.11.22 |



