환경기능사 필기 계산문제 요약
pH, pOH 농도 구하기
pH 에서 수소이온 몰농도 구하기
용어 정리
수소이온 농도 pH, (수산화 이온 농도, pOH)
pH (hydrogen ion concentration) -
물질의 산성 및 알칼리성 정도를 H+와 OH- 이온의 몰농도의 로그 값으로 나타낸다.
pH는 수소이온농도를 그 역수의 상용대수(상용로그)로 나타낸 것
표준액의 조제는 정제수 15분 이상 끓여, 산화칼슘 흡수관을 달아 사용
산성 표준액은 3개월, 염기성 표준액은 산화칼슘 흡수관 부착 후 1개월 내에 사용
ph미터는 유리전극 및 비교 전극으로 된 검출부와 지시부로 구성
산화수(酸化數, oxidation number) -
어떤 분자나 이온 중에 있는 각 원자에 부여된 수치로서 원자가 원소 형태로 전환하는 과정에서 이론적으로 취득하거나 [양성 산화수], 상실하는 [음성산화수] 전자의 수를 표시하는 것이다.
수소이온 농도 공식
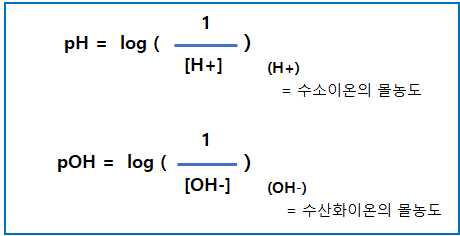
pH = log (1 / [H+])
pOH = log(1 / [OH-])
pH + pOH =14
역으로도 계산이 가능하고 문제도 나온다.
[H+] = 10^-ph
[OH-] = 10^-ph
** [H+] mol/L : 수소이온의 몰농도,
중요한 것은 반응하는 수소이온의 몰농도이다.
2H+로 반응하면 2배가 된다는 것을 잊으면 안된다.
** [OH-] mol/L : 수산화 이온의 몰농도(마찬가지이다.)
** 필기시험에 자주 나오는 문제이다. 확실히 이해하고 넘어가야 한다.
계산문제 풀이
■문제 : 0.01M 염산 용액(HCL, 염화수소)의 pH 농도는? (100% 완전 해리 기준)
H+ 가 1몰로 반응
HCL의 반응식 = H+ + CL-
HCL, 0.01M = 0.01M의 H+ 이온과 반응한다. (1:1로 반응한다)
H+ 몰농도는 0.01M이다.
pH = log(1 / 0.01) = log(1) - log(10^-2)
= 0 - (-2) = 2
환경기능사 시험에 나오는 상용로그는 여기에
■문제 : 1mM의 수산화칼슘 수용액의 pH 농도는? (100% 완전 해리 기준)
pH농도를 구하는 것이다.
OH- 는 2몰로 Ca2+ 와 반응한다.
1mM 의 농도 = 0.001M
반응식 Ca(OH) 2 = Ca2+ 2OH-
Ca2+ 1개에 OH- 2개가 반응한다.(1:2 반응)
2OH- 의 몰농도
= 2 x 1mM = 2mM
= 0.002M
pOH = log(1 / 0.002) = log(1) - log( 2 X 0.001)
= 0 - (log2 + log(10^-3)
= 0 - (log2 - 3)
= 2.698
pH = 14 - pOH(2.698)
**pOH가 아니라 pH를 구하는 것이다.
pH = 11.30
■문제 : 0.00001M 염산 용액(HCL, 염화수소)의 pH 농도는? (100% 완전 해리 기준)
H+ 가 1몰로 반응
HCL의 반응식 = H+ + CL-
HCL, 0.01M = 0.01M의 H+ 이온과 반응한다. (1:1로 반응한다)
H+ 몰농도는 0.00001M이다.
0.00001 = 10^-5, 그냥 봐도 5가 나올 것으로 보인다.
pH = log(1 / 0.00001) = log(1) - log(10^-5)
= 5
■문제 :pH 가 3.5 인 용액의 H+ 이온은 몇 mole/L 인가 ?
pH를 주고 수소이온 농도를 구하는 문제이다.
pH = log(1/H+)
H+ = 10^-ph
이공식을 알면 쉽지만 모른다면
그냥 기존 공식에다가 넣으면 된다.
3.5 = log(1/H+)
= log(1) - log(H+)
log(H+) = log(1) - 3.5
log(H+) = 0 - 3.5
log(H+) = - 3.5
H+ = 10^-3.5
** H+ = 10^-ph
■■
'기능사자격증으로 > 환경기능사 필기 대비' 카테고리의 다른 글
| 쓰레기 배출량, 수거능력(MHT) 구하기 - 환경기능사 필기 계산문제 요약 (0) | 2022.05.22 |
|---|---|
| 원자량과 분자량 계산 - 환경기능사 필기 계산문제 요약 (0) | 2022.05.22 |
| ppm 환산하기 - 환경기능사 필기 계산문제 요약 (0) | 2022.05.22 |
| 몰농도(mol) 구하기 - 환경기능사 필기 계산문제 요약 (0) | 2022.05.22 |
| 수질오염 생물학적 처리방법 - 환경기능사 필기대비 요약 (0) | 2022.05.17 |
| 수질오염 화학적 처리방법 - 환경기능사 필기대비 요약 (0) | 2022.05.17 |
| 수질오염 고도처리공정 - 환경기능사 필기대비 요약 (0) | 2022.05.15 |

